普通化学(B) 知到智慧树答案2024 z43291
绪论 单元测试
1、 化学是在原子和分子水平上研究物质的组成、结构和性质及其变化规律和变化过程中能量关系的科学。( )
A:对
B:错
答案:
对
2、 燃烧是是物质失去燃素,空气得到燃素的过程。( )
A:对
B:错
答案:
错
3、 《物理化学杂志》创办的创办标志着物理化学体系的诞生。( )
A:对
B:错
答案:
对
4、 通常来说,化学可以分为无机化学、有机化学、分析化学、物理化学。( )
A:对
B:错
答案:
对
第一章 单元测试
1、 波函数ψ是描述微观粒子运动的数学函数式。( )
A:对
B:错
答案:
对
2、 微观粒子的特性主要是波、粒二象性。( )
A:对
B:错
答案:
对
3、
1s轨道上只可容纳1个电子。( )
A:对
B:错
答案:
错
4、 主量子数n=3时,有3s,3p,3d,3f等四种原子轨道。( )
A:对
B:错
答案:
错
5、 一组n,l,m,ms组合可表述核外电子一种运动状态。( )
A:对
B:错
答案:
对
6、 d区元素外层电子构型是ns1~2。( )
A:对
B:错
答案:
错
7、 同周期元素从左至右原子半径减小。( )
A:对
B:错
答案:
错
8、 NH3和BF3都是4原子分子,所以二者空间构型相同。( )
A:对
B:错
答案:
错
9、 色散力只存在于非极性分子之间,取向力只存在于极性分子之间。( )
A:对
B:错
答案:
错
10、 分子中的化学键为极性键,则分子为极性分子。( )
A:对
B:错
答案:
错
11、 非极性分子内的化学键一定是非极性键。( )
A:对
B:错
答案:
错
12、 下列电子的各套量子数,可能存在的是( )。
A:3,2,2,+1/2
B:3,0,1,+1/2
C:2,-1,0,-1/2
D:2,0,-2,+1/2
答案:
3,2,2,+1/2
13、 用下列各组量子数来表示某一电子在核外的运动状态,其中合理的是( )。
A:n = 3,l = 1,m = 2,ms = +1/2
B:n=3,l = 2, m = 1,ms = -1/2
C:n = 2,l = 0,m = 0,ms = 0
D:n=2,l = -1,m = 1,ms = +1/2
答案:
n=3,l = 2, m = 1,ms = -1/2
14、 当n = 4,l = 0,m =( )。
A:4
B:0
C:1
D:2
答案:
0
15、 39号元素钇的电子排布式应是下列排布的哪一种( )。
A:1s22s22p63s23p63d104s24p64d15s2
B:1s22s22p63s23p63d104s24p65s25p1
C:1s22s22p63s23p63d104s24p65s24d1
D:1s22s22p63s23p63d104s24p65s25d1
答案:
1s22s22p63s23p63d104s24p64d15s2
16、 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在元素周期表中属于( )。
A:ⅤB族
B:ⅢB族
C:Ⅷ族
D:ⅤA族
答案:
Ⅷ族
17、 下列4种电子构型的原子中第一电离能最低的是( )。
A:ns2np3
B:ns2np4
C:ns2np5
D:ns2np6
答案:
ns2np4
18、 下列说法中正确的是( )。
A:BCl3分子中B—Cl键是非极性的。
B:BCl3分子中B—Cl键不都是极性的。
C:BCl3分子是极性分子,而B—Cl键是非极性的。
D:BCl3分子是非极性分子,而B—Cl键是极性的。
答案:
BCl3分子是非极性分子,而B—Cl键是极性的。
19、 下列各分子中,是极性分子的为( )。
A:BeCl2
B:BF3
C:NF3
D:C6H6
答案:
NF3
20、 H2O的沸点是100℃,H2Se的沸点是-42℃,这可用下列哪种理论来解释( )
A:范德华力
B:共价键
C:离子键
D:氢键
答案:
氢键
21、 下列分子中不能形成氢键的是( )。
A:NH3
B:N2H4
C:C2H5OH
D:HCHO
答案:
HCHO
22、 下列晶体中,熔化时只需克服色散力的是( )。
A:K
B:SiF4
C:H2O
D:SiC
答案:
SiF4
第二章 单元测试
1、 一般晶格能越大的离子晶体,熔点越高,硬度也越大。( )
A:对
B:错
答案:
对
2、 聚集状态相同的物质在一起,一定是单相体系。( )
A:对
B:错
答案:
错
3、 某温度下,容器中充有2.0 mol N2(g)和1.0 mol Ar(g)。若混合气体的总压力p = 1.5 kPa,则Ar (g) 的分压pAr = 0.5 kPa。( )
A:对
B:错
答案:
对
4、 一定温度下,将等物质的量的气态CO2和O2装入同一容器中,则混合气体的压力等于( )。
A:CO2单独存在时的压力
B:O2单独存在时的压力
C:CO2和O2单独存在时的压力之和
D:CO2和O2单独存在时的压力之积
答案:
CO2和O2单独存在时的压力之和
5、 25℃,总压为100 kPa,充有36 g H2,28 g N2 的容器中,H2的分压为( )。
A:94.7 kPa
B:94.7 Pa
C:5.26 kPa
D:5.26Pa
答案:
94.7 kPa
6、 下列属于分子晶体的是( )。
A:KCl
B:Fe
C:H2O(s)
D:SiC(s)
答案:
H2O(s)
7、 下列物质熔点由低至高的排列顺序为( )。
A:CCl4<CO2<SiC<CsCl
B:CO2<CCl4<SiC<CsCl
C:CO2<CCl4<CsCl<SiC
D:CCl4<CO2<CsCl<SiC
答案:
CO2<CCl4<CsCl<SiC
第三章 单元测试
1、 系统的状态改变时,至少有一状态函数改变。( )
A:对
B:错
答案:
对
2、 系统的状态函数之一发生改变时,系统的状态不一定改变。( )
A:对
B:错
答案:
错
3、 式∆U = Q+W表明系统在恒压,只做体积功条件下,变化过程中系统与环境间进行的能量的交换。( )
A:对
B:错
答案:
错
4、 若恒压过程中,Qp = – 150 kJ·mol-1,W = 310 kJ·mol-1,则∆U = – 150 kJ·mol-1。( )
A:对
B:错
答案:
错
5、 化学反应的反应热只与反应的始态和终态有关,而与变化的途径无关。( )
A:对
B:错
答案:
对
6、 1 mol 100℃,100 kPa 下的水变成同温同压下的水蒸气,该过程的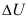 =0。( )
=0。( )
A:对
B:错
答案:
错
7、 因为金刚石坚硬,所以其在298.15 K时的标准摩尔生成焓为0。( )
A:对
B:错
答案:
错
8、 25℃,标准压力下,反应CaO(s)+CO2(g)= CaCO3(s)的焓变就是CaCO3(s)的标准摩尔生成焓。( )
A:对
B:错
答案:
错
9、 在定温定压条件下, H2(g) + 1/2O2(g) == H2O(l) 和2H2(g) + O2(g) == 2H2O(l) 所表达的反应放出的热量是一相同的值。( )
A:对
B:错
答案:
错
10、 已知:C(石墨) + O2(g) = CO2(g) ,∆rHmƟ (298K) = -393.509 kJ·mol-1,C(金刚石) + O2(g) = CO2(g),∆rHmƟ (298K) = -395.404 kJ·mol-1,则∆fHmƟ (C,金刚石,298K) = 1.895 kJ·mol-1。( )
A:对
B:错
答案:
对
11、 ∆fSmƟ (C,石墨,298K)= 0。( )
A:对
B:错
答案:
错
12、 活性炭表面吸附氧气的过程中熵变的数值是正值。( )
A:对
B:错
答案:
错
13、 反应Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) 的∆rSmƟ (298K) = 15.2 J·mol-1·K-1,则∆rSmƟ (500K) ≈ 15.2 J·mol-1·K-1。( )
A:对
B:错
答案:
对
14、 已知:C(石墨) +1/2O2(g) = CO(g) 的∆rGmƟ (CO,g,298K) = -137.168 kJ·mol-1,则∆fGmƟ (CO,g,298K) = -137.168 kJ·mol-1。( )
A:对
B:错
答案:
对
15、 因为∆rHmƟ (T )≈∆rHmƟ (298K),∆rSmƟ (T )≈∆rSmƟ (298K),所以∆rGmƟ (T )≈ ∆rGmƟ (298K)。( )
A:对
B:错
答案:
错
16、 因为∆rGm = ∆rGmƟ (T) + RTln Q,所以在标准状态下不能自发进行的反应,在非标准状态下也一定不能自发进行。( )
A:对
B:错
答案:
错
17、 一个反应,如果∆rHmƟ > ∆rGmƟ,则必是熵增大的反应。( )
A:对
B:错
答案:
对
18、 ∆H<0,∆S>0的反应是在任何温度下都能自发进行的反应。( )
A:对
B:错
答案:
对
19、 已知某自发进行的反应的∆rHmƟ (T )>0,则若反应温度升高,KƟ增大。( )
A:对
B:错
答案:
对
20、 对反应系统C(s)+H2O(g) ===CO(g) + H2(g),∆rHmƟ (298.15K)=131.3 kJmol-1。由于化学方程式两边物质的化学计量数的总和相等,所以增加总压力对平衡无影响。( )
A:对
B:错
答案:
错
21、 下列物理量中,可以确定其绝对值的为 ( )。
A:H
B:U
C:G
D:S
答案:
S
22、 被绝热材料包围的房间内放有一电冰箱,将电冰箱门打开的同时向冰箱供给电能而使其运行。室内的温度将( )。
A:逐渐升温
B:逐渐降低
C:不发生变化
D:无法确定
答案:
逐渐升温
23、 如果体系经过一系列变化后,又变回初始状态,则体系的( )。
A:Q=0,W=0,∆U =0,∆H =0;
B:Q ≠ 0,W≠0,∆U=0,∆H =Q
C:Q=-W,∆U = Q+W,∆H =0;
D:Q ≠ W,∆U = Q+W,∆H =0
答案:
Q=-W,∆U = Q+W,∆H =0;
24、 在标准压力和373K下,水蒸气凝聚为液态水时体系中应是( )。
A:ΔH=0
B:ΔS=0
C:ΔG=0
D:ΔU=0
答案:
ΔG=0
25、 在下列反应中,反应( )所放出的热量最少。
A:CH4(l)+2O2(g) === CO2(g)+2H2O(g)
B:CH4(g)+2O2(g) === CO2(g)+2H2O(g)
C:CH4(g)+2O2(g) === CO2(g)+2H2O(l)
D:CH4(g)+3/2O2(g) === CO(g)+2H2O(l)
答案:
CH4(g)+3/2O2(g) === CO(g)+2H2O(l)
26、 反应Na2O(s)+I2(g)==2NaI(s)+1/2O2(g)的∆rHmƟ为( )。
A:2∆fHmƟ(NaI,s)-∆fHmƟ(Na2O,s)
B:∆fHmƟ(NaI,s )-∆fHmƟ(Na2O,s)-∆fHmƟ(I2,g)
C:2∆fHmƟ(NaI,s)-∆fHmƟ(Na2O,s)-∆fHmƟ(I2,g)
D:∆fHmƟ(NaI,s)-∆fHmƟ(Na2O,s)
答案:
2∆fHmƟ(NaI,s)-∆fHmƟ(Na2O,s)-∆fHmƟ(I2,g)
27、 CuCl2(s)+Cu(s)==2CuCl(s) ∆rHmƟ ==170 kJ·mol-1
Cu(s)+ Cl2(g)=CuCl2(s) ∆rHmƟ == -206 kJ·mol-1
则CuCl(s)∆RHmƟ为( )kJ·mol-1。( )
A:36
B:18
C:-18
D:-36
答案:
-18
28、 若CH4(g),CO2,H2O(l)的∆fGmƟ分别为-50.8,-394.4,-237.2 kJ·mol-1,则298K时,CH4(g)+2O2(g)==CO2(g)+2H2O(l)的∆RGmƟ为( ) kJ·mol-1。
A:–818
B:818
C:–580.8
D:580.8
答案:
–818
29、 已知C2H6(g)+7/2O2(g) = 2CO2(g) +3H2O(l),C2H6(g)、CO2(g)、H2O(l)的∆fHmƟ(kJ·mol-1)分别为:-85、-394、-286,试求上述反应的∆rHmƟ为( )。
A:∆rHmƟ = -85+394+286(kJ·mol-1)
B:∆rHmƟ = -394+85-286(kJ·mol-1)
C:∆rHmƟ = -85-2×(-394)-3×(-286)(kJ·mol-1)
D:∆rHmƟ = 2×(-394)+3×(-286)-(-85)(kJ·mol-1)
答案:
∆rHmƟ = 2×(-394)+3×(-286)-(-85)(kJ·mol-1)
30、 在标准条件下石墨燃烧反应的焓变为-393.7 kJ·mol-1,金刚石燃烧反应的焓变为-395.6 kJ·mol-1,则石墨转变为金刚石反应的焓变为( ) kJ·mol-1。
A:-789.3
B:0
C:1.9
D:-1.9
答案:
1.9
31、 关于熵,下列叙述中正确的是( )。
A:298K时,纯物质的SmƟ =0
B:一切单质的SmƟ=0
C:对孤立体系而言,ΔrSmƟ>0的反应总是自发进行的
D:在一个反应过程中,随着生成物的增加,熵变增加
答案:
对孤立体系而言,ΔrSmƟ>0的反应总是自发进行的
32、 以下说法正确的是( )。
A:放热反应都可以自发进行
B:凡∆rGmƟ >0 的反应都不能自发进行
C:∆rHmƟ >0及∆rSmƟ >0 的反应在高温下有可能自发进行
D:纯单质的∆fHmƟ、∆fGmƟ及SmƟ皆为0
答案:
∆rHmƟ >0及∆rSmƟ >0 的反应在高温下有可能自发进行
33、 某反应2AB(g)→ A(g)+ 3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该正反应的∆rHmƟ (T)和∆rSmƟ (T)应为( )。
A:∆rHmƟ (T)<0,∆rSmƟ (T)>0
B:∆rHmƟ (T)<0,∆rSmƟ (T)<0
C:∆rHmƟ (T)>0,∆rSmƟ (T)>0
D:∆rHmƟ (T)>0,∆rSmƟ (T)<0
答案:
∆rHmƟ (T)>0,∆rSmƟ (T)>0
34、 反应 FeO(s) + C(s) == CO(g) + Fe(s) 的∆rHmƟ为正,∆rSmƟ为正(假定∆rHmƟ,∆rSmƟ与温度无关),下列说法中正确的是( )。
A:低温下自发过程,高温下非自发过程;
B:高温下自发过程,低温下非自发过程;
C:任何温度下均为非自发过程;
D:任何温度下均为自发过程。
答案:
高温下自发过程,低温下非自发过程;
35、 下列条件中,须通过计算过程的∆rGm(298K)判断过程自发进行方向的是( )。
A:标准状态,298.15K时
B:298.15K,过程中物质之一为非标准状态
C:298.15K,过程中所有物质均为非标准态
D:非标准状态,任意温度
答案:
298.15K,过程中物质之一为非标准状态
36、 反应2NO(g)+ O2(g)=== 2NO2(g),∆rHmƟ = -114 kJ·mol-1,∆rSmƟ = -146 J·mol-1·K-1。反应达平衡时各物质的分压均为pƟ,则反应的温度是( )。
A:780℃
B:508℃
C:482℃
D:1053℃
答案:
508℃
37、 下列叙述中错误的是( )。
A:∆rHmƟ (T)>0的反应,温度升高KƟ增大
B:一定温度下,若反应中某反应物的平衡转化率增大,该反应的KƟ必然增大
C:一定温度下,∆rGmƟ (T)越大的反应,其KƟ值越小
D:一定温度下,KƟ越大的反应进行得越彻底
答案:
一定温度下,若反应中某反应物的平衡转化率增大,该反应的KƟ必然增大
38、 在温度T时,反应2A(g) + B(g) == 2C(g) 的KƟ的值等于1,在温度T,标准状态及不作非体积功的条件下,上述反应( )。
A:能从左向右进行
B:能从右向左进行;
C:恰好处于平衡状态
D:条件不够,不能判断。
答案:
恰好处于平衡状态
39、 某温度时,反应H2(g)+Br2(g)==2HBr(g)的标准平衡常数KƟ= 410-2,则反应1/2H2(g)+1/2Br2(g) === HBr(g)的标准平衡常数KƟ等于( )。
A:50;
B:5;
C:410-2;
D:0.2
答案:
0.2
40、 NH4Ac在水溶液中存在着如下的平衡:
NH3+H2O==NH4++OH— K1Ɵ
HAc+H2O==Ac—+H3O+ K2Ɵ
NH4++Ac—==HAc+NH3 K3Ɵ
2H2O==H3O++OH— K4Ɵ
以上各反应的平衡常数之间的关系为( )。
A:K3Ɵ = K1Ɵ·K2Ɵ·K4Ɵ
B:K4Ɵ = K1Ɵ·K2Ɵ·K3Ɵ
C:K3Ɵ·K2Ɵ = K1Ɵ·K4Ɵ
D:K3Ɵ·K4Ɵ = K1Ɵ·K2Ɵ
答案:
K4Ɵ = K1Ɵ·K2Ɵ·K3Ɵ
41、 20℃时,过程 NH3(l) === NH3(g) 达到平衡时,若体系的氨蒸汽压力为8.57×105Pa,则其KƟ的数值为( )。
A:8.57×105
B:8.46
C:8.57
D:0.118
答案:
8.57
42、 没有其它已知条件,下列( )物理量增加一倍时,已达平衡的反应3A(g) + 2B(g) === 2C(g) + D(g) 的平衡移动方向无法确定。( )
A:温度;
B:总压力;
C:物质A的分压;
D:物质D的分压。
答案:
温度;
43、 已知反应1/2N2(g) + CO2(g) ==== NO(g)+CO(g)的DrHmƟ (298.15K) = 373.2 kJmol-1,要有利于取得有毒气体NO和 CO的最大转化率,可采取的措施是( )。
A:低温低压;
B:高温高压;
C:低温高压;
D:高温低压
答案:
低温高压;
44、 反应 2NO(g) + O2(g) == 2NO2(g) 是放热的, 当反应在某温度、压力下达平衡时,若使平衡向右移动。则应采取的措施是( )。
A:降低温度和减小压力
B:降低温度和增大压力;
C:升高温度和减小压力
D:升高温度和增大压力。
答案:
降低温度和增大压力;
45、 某一反应在一定条件下的平衡转化率为25.3%,当有一催化剂存在时,其转化率为( )。
A:大于25.3%
B:等于25.3%
C:小于25.3%
D:约等于25.3%
答案:
等于25.3%
46、 合成氨反应3H2(g)+N2(g)==2NH3(g)在恒压下进行时,若向体系内引入氩气,则氨的产率( )。
A:减小
B:增大
C:不变
D:无法判断
答案:
减小
47、 对于反应2Cl2(g)+2H2O(g)==4HCl(g)+O2(g)∆rHmƟ>0,今将Cl2(g)、H2O(g)、HCl(g)、O2(g)混合,并在反应达到平衡时,改变下述条件,其中不能使平衡移动的是( )。
A:增加容器体积
B:降低温度
C:加入氧气
D:加入催化剂
答案:
加入催化剂
第四章 单元测试
1、 10升0.1 mol·dm-3的葡萄糖水溶液比2升0.1 mol·dm-3的蔗糖水溶液的渗透压大。( )
A:对
B:错
答案:
错
2、 难挥发电解质稀溶液的依数性不仅与溶质种类有关,而且与溶液浓度成正比。( )
A:对
B:错
答案:
错
3、 酸碱质子理论中酸碱反应的实质是酸和碱反应生成了盐和水的反应。( )
A:对
B:错
答案:
错
4、 弱碱的解离常数Kb只与溶液温度有关,而与其浓度无关。( )
A:对
B:错
答案:
对
5、 多元弱酸,其酸根离子浓度近似等于该酸的一级解离常数。( )
A:对
B:错
答案:
错
6、 在一定温度下,弱酸的解离度越大,其溶液的pH值越大。( )
A:对
B:错
答案:
错
7、 将适量的NaAc晶体加入HAc水溶液中,则Ka (HAc)值会增大。( )
A:对
B:错
答案:
错
8、 用0.1 mol·dm-3 NaOH分别中和10 mL 0.1 mol·dm-3HCl和10 mL 0.1 mol·dm-3的H Ac溶液时,所用的NaOH溶液的体积是相同的。( )
A:对
B:错
答案:
对
9、 Na2CO3和NaOH的混合溶液具有缓冲性能。( )
A:对
B:错
答案:
错
10、 将氨水的浓度稀释一倍,溶液的OH-浓度就减少到原来的1/2。( )
A:对
B:错
答案:
错
11、 PbI2和CaCO3的溶度积都近似为10-9,但两者的溶解度(mol·dm-3)却不相等。( )
A:对
B:错
答案:
对
12、 在PbI2饱和溶液中加入少量Pb(NO3)2固体,将会发现有黄色PbI2沉淀生成,这是因为Pb(NO3)2的存在使PbI2的溶解度降低而形成沉淀。( )
A:对
B:错
答案:
对
13、 Ksp{[Zn(OH)2]} = 3.0×10-17,K不稳{[Zn(OH)4]2-} = 2.2×10-18,则反应Zn(OH)2 + 2OH-→ [Zn(OH)4]2-的平衡常数K= 6.6×10-35。( )
A:对
B:错
答案:
错
14、 Mg(OH)2在NH4Cl溶液中的溶解度比在MgCl2溶液中大。( )
A:对
B:错
答案:
对
15、 取相同质量的下列物质融化路面的冰雪,( )最有效?
A:氯化钠
B:氯化钙
C:尿素[CO(NH2)2]
答案:
氯化钙
16、 两只各装有1kg水的烧杯, 一只溶有0.01mol蔗糖,另一只溶有0.01molNaCl, 按同样速度降温冷却, 则( )。
A:溶有蔗糖的杯子先结冰
B:两杯同时结冰
C:溶有NaCl的杯子先结冰
D:视外压而定
答案:
溶有NaCl的杯子先结冰
17、 在一定的外压下,易挥发的纯溶剂A中加入不挥发的溶质B形成稀溶液。此稀溶液的沸点随着bB的增加而( )。
A:升温
B:降低
C:不发生变化
D:无一定变化规律
答案:
升温
18、 为马拉松运动员沿途准备的饮料应该是( )。
A:高脂肪、高蛋白、高能量饮料
B:20% 葡萄糖水
C:含适量维生素的等渗饮料
D:含兴奋剂的饮料
答案:
含适量维生素的等渗饮料
19、 盐碱地的农作物长势不良,甚至枯萎,其主要原因是( )。
A:天气太热
B:很少下雨
C:肥料不足
D:水分从植物向土壤倒流
答案:
水分从植物向土壤倒流
20、 与0.58% NaCl溶液产生的渗透压较接近的是溶液( )。
A:0.1 mol·dm-3 蔗糖溶液
B:0.2 mol·dm-3 葡萄糖溶液
C:0.1 mol·dm-3 葡萄糖溶液
D:0.1 mol·dm-3 BaCl2溶液
答案:
0.2 mol·dm-3 葡萄糖溶液
21、 自然界中,有的树木可高达100m,能提供营养和水分到树冠的主要动力为( )。
A:因外界大气压引起树干内导管的空吸作用
B:树干中微导管的毛吸作用
C:树内体液含盐浓度高,其渗透压大
D:水分与营养自雨水直接落到树冠上
答案:
树内体液含盐浓度高,其渗透压大
22、 根据质子理论判断下列( )是共轭酸碱对。
A:HCO3–~H2CO3
B:PO43-~H2PO4–
C:NH2NH2~NH4+
D:Al (H2O)33+~Al (H2O)63+
答案:
HCO3–~H2CO3
23、 已知H3AsO4的逐级酸常数分别为Ka1Ɵ、Ka2 Ɵ、Ka3 Ɵ,则HAsO42-离子的Kb Ɵ值及其共轭酸为( )。
A:Kw Ɵ / Ka2 Ɵ,H2AsO4-
B:Kw Ɵ / Ka3 Ɵ,H2AsO4-
C:Kw Ɵ / Ka2 Ɵ,H3AsO4
D:Kw Ɵ / Ka3 Ɵ,H3AsO4
答案:
Kw Ɵ / Ka2 Ɵ,H2AsO4-
24、 在稀HAc溶液中,加入等物质的量的固体NaAc,其混合溶液中不变的是( )。
A:pH值
B:解离度
C:解离常数
D:OH—的浓度
答案:
解离常数
25、 下列溶液中,pH值最小的是( )。
A:0.010mol·dm-3 HCl
B:0.010mol·dm-3 H2C2O4
C:0.010 mol·dm-3 HAc
D:0.010 mol·dm-3 H2SO4
答案:
0.010 mol·dm-3 H2SO4
26、 酸的强度越大( )。
A:其解离出来的H+越多
B:其中和的碱越多
C:其Ka Ɵ值越大
D:其共轭碱的Kb Ɵ值越大
答案:
其Ka Ɵ值越大
27、 在H2S水溶液中,加入一些Na2S固体,将使( )。
A:H2S解离度增大
B:H2S平衡常数减小
C:溶液pH值下降
D:溶液pH值增大
答案:
溶液pH值增大
28、 在0.1 mol·dm-3 H2S饱和溶液中,S-2浓度为( )。
A:0.1 mol·dm-3
B:0.05 mol·dm-3
C:Ka1 Ɵ (H2S)
D:Ka2 Ɵ (H2S)
答案:
Ka2 Ɵ (H2S)
29、 100mL 0.10mol·dm-3 HAc溶液中,加入少量NaAc固体,则溶液的pH值( )。
A:变小
B:不能判断
C:不变
D:变大
答案:
变大
30、 下列混合溶液具有缓冲作用的是( )。
A:0.2 mol·dm-3 NaAc和 0.2 mol·dm-3 HCl溶液等体积混合
B:0.2 mol·dm-3 HAc和 0.1 mol·dm-3NaOH溶液等体积混合
C:0.2 mol·dm-3 NH4Cl和 0.2 mol·dm-3NaOH溶液等体积混合
D:0.2 mol·dm-3 HCl和 0.2 mol·dm-3NaCl溶液等体积混合
答案:
0.2 mol·dm-3 HAc和 0.1 mol·dm-3NaOH溶液等体积混合
31、 欲配制pH为5.5的缓冲溶液,应选下列( )物质。
A:HAc(pKa Ɵ = 4.74)与其共轭碱
B:甲酸(pKa Ɵ =3.74)与其共轭碱
C:六次甲基四胺(pKb Ɵ =8.85)与其共轭酸
D:氨水(pKb Ɵ = 4.74)与其共轭酸
答案:
六次甲基四胺(pKb Ɵ =8.85)与其共轭酸
32、 在1L 0.12 mol·dm-3 NaAc 和0.10 mol·dm-3 HAc混合液中加入4克NaOH,该体系的缓冲能力将( )。
A:不变
B:变小
C:变大
D:难以判断
答案:
变小
33、 25℃时,已知AgCl(s)→ Ag+(aq)+Cl–(aq)的DrGm Ɵ = 55.7 kJ·mol-1,则AgCl的Ksp Ɵ为( )。
A:1.74×10-10
B:3.4×10-10
C:5.0×10-11
D:8.9×10-9
答案:
1.74×10-10
34、 CaF2饱和溶液的浓度为2×10-4mol· dm-3,其溶度积常数为( )。
A:8×10-10
B:8×10-12
C:4×10-8
D:3.2×10-11
答案:
8×10-12
35、 在BaSO4饱和溶液中加入少量BaCl2稀溶液,产生BaSO4沉淀,若以Ksp Ɵ表示BaSO4的溶度积常数,则平衡后溶液中( )。
A:c (Ba2+) = c (SO42-) = (Ksp Ɵ)1/2
B:c (Ba2+)·c (SO42-) >Ksp Ɵ,c (Ba2+) = c (SO42-)
C:c (Ba2+)·c (SO42-) = Ksp Ɵ,c (Ba2+) > c (SO42-)
D:c (Ba2+)·c (SO42-) ≠Ksp Ɵ,c (Ba2+) < c (SO42-)
答案:
c (Ba2+)·c (SO42-) = Ksp Ɵ,c (Ba2+) > c (SO42-)
36、 在下列溶液中,BaSO4的溶解度最大的是( )。
A:1 mol · dm-3 H2SO4
B:2 mol · dm-3 H2SO4
C:纯水
D:0.1 mol · dm-3 H2SO4
答案:
纯水
37、 AgCl沉淀在( )中溶解度最大。
A:2 mol·dm-3 NH3溶液
B:2 mol·dm-3 NaCl溶液
C:纯水
D:2 mol·dm-3 NH3和2 mol·dm-3 NH4Cl混合溶液
答案:
2 mol·dm-3 NH3溶液
38、 已知在Ca3(PO4)2的饱和溶液中,c(Ca2+) = 2.0×10—6 mol·dm-3,c(PO43—)=1.58×10—6 mol·dm-3,则Ca3(PO4)2的溶度积常数为( )。
A:2.0×10—29
B:3.2×10—12
C:6.3×10—18
D:5.1×10—27
答案:
2.0×10—29
39、 某溶液中含有KCl、KBr和K2CrO4,其浓度均为0.010mol·dm-3,向该溶液中逐滴加入0.010mol·dm-3 的 AgNO3 溶液时,最先和最后沉淀的是( )。
(已知:K spƟ (AgCl)= 1.56×10-10,K spƟ (AgBr)= 7.7×10-13,K spƟ (Ag2CrO4)= 9.0×10-12)
A:AgBr和Ag2CrO4
B:Ag2CrO4和AgCl
C:AgBr和AgCl
D:共沉淀
答案:
AgBr和Ag2CrO4
40、 在FeCl3和KSCN的混合溶液中,加入少量NaF溶液,其现象是( )。
A:变成红色
B:颜色变浅
C:颜色加深
D:产生沉淀
答案:
颜色变浅
41、 已知K稳Ɵ {[Ag(SCN)2]-} = 3.72×107, K稳Ɵ {[Ag(NH3)2]-} = 1.12×107, 当SCN-离子浓度为0.1mol·dm-3,其余有关物质浓度均为1.0 mol·dm-3时,反应 [Ag(NH3)2]+ + 2SCN-→ [Ag(SCN)2]- + 2NH3 进行的方向为( )。
A:向左进行
B:向右进行
C:恰好达平衡状态
D:无法预测
答案:
向右进行
下方是付费阅读内容:本平台商品均为虚拟商品,无法用作二次销售,不支持退换货,请在购买前确认您需要购买的资料准确无误后再购买,望知悉!
完整答案需点击上方按钮支付5元购买,所有答案均为章节测试答案,无期末答案。购买后上方矩形框将出现已付费的隐藏内容。
点关注,不迷路,微信扫一扫下方二维码
关注我们的公众号:阿布查查 随时查看答案,网课轻松过

为了方便下次阅读,建议在浏览器添加书签收藏本网页
电脑浏览器添加/查看书签方法
1.按键盘的ctrl键+D键,收藏本页面

2.下次如何查看收藏的网页?
点击浏览器右上角-【工具】或者【收藏夹】查看收藏的网页

手机浏览器添加/查看书签方法
一、百度APP添加/查看书签方法
1.点击底部五角星收藏本网页

2.下次如何查看收藏的网页?
点击右上角【┇】-再点击【收藏中心】查看

二、其他手机浏览器添加/查看书签方法
1.点击【设置】-【添加书签】收藏本网页

2.下次如何查看收藏的网页?
点击【设置】-【书签/历史】查看收藏的网页

